药物杂质专利的创造性评价--简评氯维地平降解
2017-04-16 鲁礼炎 知识产权律师
药物杂质专利的创造性评价
----简评氯维地平降解物专利无效案
作者:鲁礼炎 隆安(上海)律师事务所 合伙人律师 专利代理人。主要从事生物技术及制药领域专利申请、专利分析与布局、专利实施与转化;专利无效、专利侵权诉讼等。鲁律师先后就读于华东政法大学法律学院、上海交通大学药学院。
导读
本案专利涉及氯维地平药物组合物及其代谢产物杂质,北京蓝丹医药科技有限公司向复审委对该专利提出了无效申请,复审委于近日宣布该专利全部无效。本周研读以该案无效决定内容进行简要解读,并就药物杂质相关的专利创造性进行了简要评析。
1裁判要点
1)、对于限定杂质含量的产品权利要求,如果仅仅是发现了现有技术产品中存在的新杂质及其含量,在无法排除现有技术的产品客观存在所述杂质含量,且新杂质的发现没有为产品带来预料不到的技术效果的情况下,这种发现不会使产品权利要求具备创造性。
2)、发现药物的降解物本身并不能为药物组合物带来创造性,形成药物组合物本身的药物产品纯度水平与组合物的组成、其制备方法有关,与是否被发现和是否被测量无关。并且,在常规的药学研究中,测量并限定药物的杂质含量对于本领域技术人员而言是显而易见的。
3)、高纯度的药物组合物,意味着药物的活性成分的百分比更高、药效更好,尽可能降低各种杂质的水平是行业内所普遍追求的。因此,在已经公开的药物制剂的基本组合物配方的基础上,本领域技术人员有动机寻求尽可能高纯度、各种杂质含量低的药物组合物,并且所产生的技术效果也是可以预期的
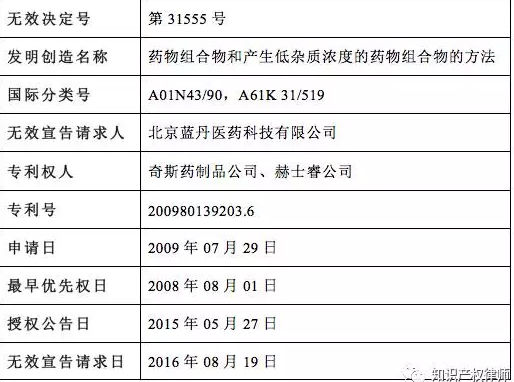
2、涉案专利信息
2.1 专利基本信息:
2.2 何为氯维地平?
氯维地平(Clevidipine),也称作Cleviprex TM,是短效的血管选择性钙拮抗剂,已显示其降低动脉血压,同时由于血液和组织酯酶的代谢,该效果迅速终止。作为动脉-选择性血管扩张剂,氯维地平直接降低外周血管阻力,而不扩张静脉容量床(venous capacitance bed)。而且氯维地平典型地制成适合于静脉内施用的液体乳剂。
氯维地平的化学名称是4-(2′,3′-二氯苯基)-1,4-二氢-2,6-二甲基-3,5-吡啶二羧酸丁酰氧甲基甲酯(C21H23Cl2NO6)。
2.3 权利要求简述
本案权利要求1请求保护一种氯维地平药物组合物,其中限定了氯维地平的降解物即物质23、24、25的含量,以及该药物制成乳剂时的pH值范围、药物含量、及相配伍的脂相、乳化剂、和水的重量百分比。
权利1中的物质23、24、25是作为危害氯维地平药物纯度的降解杂质而存在,物质23、24、25的含量是随着药物储存温度、时间等外部环境参数而动态变化的,因此,在权利要求1的技术方案中,物质23、24、25的含量水平实质上体现的是组合物产品中氯维地平药物纯度的动态变化。
权利要求2所述的降解物H168/79能够通过水解和缩合进一步降解为权利要求1中所述的物质23、24、25。
3、裁判解读
3.1 权利要求1的创造性评价
下面按照标准的创造性三步法来评价权利1的创造性:
3.1.1 最接近的现有技术
证据1:公开号为CN1136774A的中国发明专利申请公开说明书。
3.1.2 确定发明的区别技术特征和发明实际解决的技术问题
区别技术特征:通过比对申请人提交的证据,法院认为:权利要求1保护的技术方案与证据1公开的内容相比,区别在于:
证据1没有公开(1)乳剂的pH值范围;
以及(2)物质23、24和25及其含量。
发明实际解决的技术问题:
专利说明书中记载:本专利的目的在于提供对其最终效力和杂质水平具有可接受的稳定性特征的组合物,和用于维持含有氯维地平作为活性成分的组合物的稳定性的方法。但是,证据1的乳剂同样具有好的稳定性。在没有进一步证据支持的情况下,无法确定上述区别技术特征使得权利要求1的药物组合物相比于证据1的乳剂在稳定性方面具有任何优异之处。因此,基于上述区别,虽然本专利发现了氯维地平乳剂中存在降解物23、24、25,但这仅仅是一种发现,权利要求1实际解决的技术问题是提供一种具体的药物组合物。
3.1.3 是否显而易见
对于区别特征(1):
首先,证据1虽然没有具体指明乳剂pH的调节范围,但是由于其乳剂是静脉给药,作为静脉内的溶液,将其pH值调整为中性7或接近于血液的pH值对于本领域技术人员而言是显而易见的。
其次,证据2建议了无论脂肪乳注射液的用途是用于营养支持或作为药物递送载体,其pH范围为6.0-9.0。此外,本专利未提及也未以证据证明将药物组合物的pH范围限定为6-8.8产生了任何预料不到的技术效果。
对于区别特征(2):以下论述是合议组观点的重点。
合议组认为:
(1)高纯度的药物组合物,意味着氯维地平活性成分的百分比更高、药效更好,尽可能降低各种杂质的水平是行业内所普遍追求的。因此,在证据1公开的乳剂基础上,本领域技术人员有动机寻求尽可能高纯度、各种杂质含量低的药物组合物,并且所产生的技术效果也是可以预期的。
(2)就权利要求1的药物组合物与证据1的乳剂的组成而言,其组分包含作为活性成分的氯维地平、脂相、乳化剂、水或缓冲剂,而证据1的乳剂同样包含上述组分,并且含量范围也部分重叠,可见,权利要求1的药物组合物与证据1乳剂在组成上相同。
就权利要求1的药物组合物与证据1的乳剂的制备方法而言,本专利是将油加热到70℃至82℃之间,将氯维地平加入到加热的油中并将混合物加热到78℃,将蛋黄磷脂加入到混合物中,和加入水相;证据1是将氯维地平任选在加热条件下分散在脂质相中,将乳化剂任选与调色剂一起分散或溶解在水相或脂质相中,将水相加入到脂质相中或反之亦然;可见,权利要求1的药物组合物与证据1的乳剂在制备方法也基本相近。
最后,就权利要求1的药物组合物与证据1的乳剂所能达到的技术效果而言,本专利说明书中记载了所述药物组合物具有可接受的稳定性,而证据1中同样记载了所述乳剂具有更好的稳定性,并且本案中尚没有证据表明权利要求1的药物组合物相比于证据1的乳剂在稳定性方面具有任何优异之处。
可见,权利要求1的药物组合物与证据1的乳剂在技术效果尤其是稳定性方面相当,稳定性在一定程度上体现的正是氯维地平化合物的降解水平。
因此,在根据本专利说明书的记载无法确定组合物组成和制备方法中何种控制措施能够影响物质23、24、25含量,且专利权人没有提供其它证据的情况下,无法否定证据1中组成相同、制备方法相近、技术效果相当的乳剂同样能够达到权利要求1所限定的纯度水平。
(3)如前所述,由于无法确定限定乳剂中物质23、24和25的含量使得权利要求1的药物组合物相比于证据1的乳剂在稳定性方面具有任何优异之处,权利要求1的技术方案仅仅是发现了药物组合物中的降解物23、24、25,发现降解物本身并不能为药物组合物带来创造性,形成药物组合物本身的药物产品纯度水平与组合物的组成、其制备方法有关,与是否被发现和是否被测量无关。并且,在常规的药学研究中,测量并限定药物的杂质含量对于本领域技术人员而言是显而易见的。
(4)考虑到氯维地平化合物本身的化学结构,本领域技术人员根据吡啶环上的CO2CH2OCOR(R=CH2CH2CH3)基团属性能够意识到其在一定条件下水解,进而脱羧,从而降解为杂质H168/79;为了追求高纯度的药物化合物并进一步形成药物组合物,本领域技术人员有动机降低杂质H168/79的含量水平,即使未发现H168/79能够通过水解和缩合进一步降解为物质23、24、25,由于H168/79含量的降低必然带来物质23、24、25含量的降低。
此外,证据3公开了对活性物质降解产物的鉴定阈值一般要求,其公开了每日最大剂量>10mg-2g的新药制剂中,降解产物的鉴定阈值0.2%或2mg TDI(取阈值低者)。
综上所述,专利权人在证据1的脂肪乳剂的基础上发现了乳剂中的降解物23、24、25并不能为保护的药物组合物带来创造性,本领域技术人员在证据1的脂肪乳剂的基础上,既有动机、也能够寻求到如权利要求1所述的具体的pH范围和物质23、24、25含量范围的药物组合物。权利要求1的技术方案不具有专利法第22条第3款规定的突出的实质性特点和显著的进步,不具备创造性。
4、观点及建议
1、限定药物杂质的专利没有有益技术效果难以获得授权。
虽然本案申请人对药物组合物的降解产物进行了大量研究和结构确证,但是这个单纯的发现似乎并没有解决什么实质性的技术问题。笔者推测,申请人也有可能是希望在专利中通过对药物中杂质的特征和含量进行具体限定,换一种方式来保护其药物组合物,但是因为缺乏有效的或者更优异的技术效果实例,专利中也没有记载有助于降低这些杂质的含量的具体措施,所以难以满足专利创造性的标准,而且其限定的代谢产物作为杂质的含量范围还被申请日前的规定公开,这就更缺乏优势了。
2、类似专利案撰写时的建议。
杂质的限定是否能给专利带来创造性,较大程度上会依赖于杂质相关的技术特征能产生什么样的技术效果。如果杂质的发现和限定能够通过某些措施来实现,能够使产物或者制备方法等取得新的技术效果,或者与现有技术相比更好地技术效果,如某些杂质的减少、某些性能的提高等等,再通过专利进行保护才能提高授权的几率。